Cell:新研究发现一类未知的RNA分子竟可促进外周神经再生
来源:生物谷原创 2025-07-25 11:39
这项新的研究还提示了一个更广阔的前景:中枢神经系统的再生。
外周神经细胞的细长突起延伸至皮肤和内脏器官。与大脑和脊髓不同的是,外周神经细胞在受伤后具有再生能力。这就是为什么中枢神经系统损伤被认为是不可逆的,而外周神经损伤在某些情况下可以愈合,即使需要数月或数年时间。尽管经过数十年的研究,外周神经再生的机制仍然仅被部分理解。

在《细胞》杂志上发表的一项新研究中,魏茨曼科学研究所的Michael Fainzilber教授及其研究团队发现一个由数百种未知生理功能的RNA分子组成的家族对神经再生至关重要。
令人惊讶的是,这项研究显示这些RNA分子不仅能刺激小鼠外周神经系统的生长,还能促进它们的中枢神经系统再生。这些发现可能为多种神经损伤和神经退行性疾病的治疗开辟新途径。
要实现外周神经再生,必须维持神经元的胞体与其较长的轴突之间的通信。在过去二十年的系列研究中,Fainzilber实验室揭示了这种通信的关键成分:类似邮递员的蛋白质负责将控制生长因子和其他蛋白质的生产指令从胞体传递至轴突。
这些分子信使还帮助评估胞体与轴突末端之间的距离,使神经元能够相应调节其生长。然而一个核心问题仍未解决:是什么触发了损伤后的再生性生长,为何中枢神经系统细胞不会发生这种再生?
在这项新的研究中,Fainzilber实验室的Indrek Koppel博士与加州大学洛杉矶分校的Riki Kawaguchi博士合作,分析了小鼠外周神经在损伤后的一种特定基因表达模式。他们惊讶地发现,在损伤一天后,神经元增加了一个名为B2-SINE的短基因序列家族的表达,而这些序列的作用此前尚不清楚。
这些序列不编码任何蛋白质,且因其在基因组中“跳跃”的特性(即可能在错误的时间或位点出现)而声名狼藉。然而,Fainzilber团队发现,受伤后,这些神经元开始表达许多B2-SINE RNA转录本,与其他为细胞再生和修复做准备的过程同步进行。
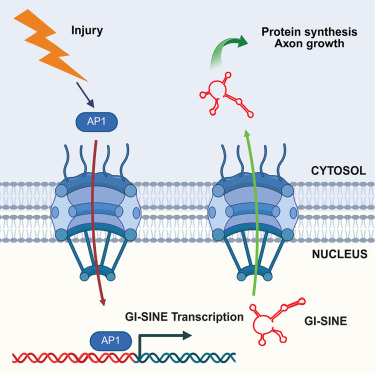
然而,B2-SINE是一个庞大的家族,包含约15万个散布于小鼠基因组中的序列。初步分析无法确定其中哪些序列负责促进生长。
Fainzilber实验室的Eitan Erez Zahavi博士利用生物信息学工具识别出453个在损伤后高度表达的B2-SINE序列,这些序列促进神经生长。他们证实,这种损伤后的过度表达仅限于外周神经细胞,而不会在中枢神经系统中发生。
外周神经领先,中枢神经跟随
Fainzilber团队随后测试了外周神经细胞中的B2-SINE是否也能刺激中枢神经系统中的神经元生长。他们诱导小鼠视网膜神经元过度表达B2-SINE类型的RNA分子,并观察到损伤后再生速度更快。
在小鼠运动皮层(通过长轴突投射至脊髓以控制肌肉运动的大脑区域)进行的类似实验显示,高水平表达B2-SINE的神经元再生速度也快于对照组神经元。
“目前仍缺乏有效治疗手段来加速神经细胞生长和再生,”Fainzilber指出,“尽管这项研究观察到的生长加速尚未足以解决临床瘫痪问题,但无疑具有重要意义。当然,从基础研究到临床应用的道路漫长,我们必须确保增强生长机制不会增加癌症风险。”
最后一个谜团仍未解开:B2-SINE RNA分子是如何促进再生的?
在加州大学旧金山分校的Alma L. Burlingame教授团队的协助下,Fainzilber团队发现,这些RNA促进了携带生长相关蛋白质合成指令的分子“信使”与读取并执行这些指令的核糖体之间的物理连接。这意味着这些关键因子的合成发生在胞体附近而非轴突末端。他们认为,这向神经元发出“体积过小”的信号,从而触发生长反应。
“人类基因组中存在超过百万个称为Alu元件的序列,相当于小鼠中的B2-SINE,”Fainzilber说,“这些分子此前已被证实能与核糖体和信使分子结合,但其作用机制尚不清楚。我们现在正试图确定Alu或其他非编码RNA元件是否参与人类神经再生。”
“外周神经损伤,或者糖尿病等影响外周神经的全身性疾病的恢复可能非常缓慢。这就是为什么我们如今正在测试一种可能通过模拟B2-SINE活性来加速再生的疗法。这种疗法涉及小分子,它们将信使分子与核糖体连接起来,同时使它们靠近神经元的胞体,促进更快生长。我们正在与魏茨曼研究所的Bina单位合作进行开展研究,以进行具有应用潜力的早期探索,”他补充道。
除了促进外周神经再生外,这项新的研究还提示了一个更广阔的前景:中枢神经系统的再生。“我们目前正与加州大学洛杉矶分校合作进行一项研究,显示我们发现的机制在小鼠模型中对中风恢复起作用。此外,我们正与特拉维夫大学、希伯来大学和舍巴医疗中心合作,研究其在肌萎缩侧索硬化症(ALS)中的潜在作用。神经退行性疾病影响着全球数以百万计的人群。尽管前路漫长,但我真挚希望我们终有一天能利用这一新发现的再生机制来治疗这些疾病,”Fainzilber 说。(生物谷Bioon.com)
参考文献:
Eitan Erez Zahavi et al, Repeat-element RNAs integrate a neuronal growth circuit, Cell (2025). DOI: 10.1016/j.cell.2025.04.030.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


